Das Office for National Statistics teilt am 1.6. mit:
»Das Vorhandensein von Antikörpern gegen SARS-CoV‑2 deutet darauf hin, dass eine Person zuvor mit COVID-19 infiziert oder geimpft worden ist. In der Woche ab dem 9. Mai 2022 liegt der Prozentsatz der Erwachsenen, bei denen Antikörper über einem Wert von 179 Nanogramm pro Milliliter (ng/ml) nachgewiesen wurden, bei:
-
-
-
- 99,4 % in England
- 99,3 % in Wales
- 99,3 % in Nordirland99,4 % in Schottland«
ons.gov.uk (1.6.)
-
-
»Antikörper und Immunität – wie hängen sie miteinander zusammen?
… Professor Sarah Walker, Professor Jeremy Farrar und Sarah Crofts erklären mehr über Antikörper und wie unser Immunsystem uns vor Infektionen schützt:
Wie das Immunsystem funktioniert:
Antikörper werden von unserem Körper nach einer Infektion und nach einer Impfung gebildet. Sie tragen dazu bei, uns vor einer erneuten Infektion zu schützen und zu verhindern, dass wir krank werden. Vor dem Impfprogramm gab die Zahl der positiv auf Antikörper getesteten Personen einen guten Hinweis auf eine frühere Infektion mit dem SARS-CoV2-Virus. Seit Beginn des Jahres 2021 haben wir die Auswirkungen der Impfung gesehen, da immer mehr Menschen positiv auf Antikörper getestet wurden, auch nach ihrer ersten Impfdosis.
Wie jedes Virus besteht auch SARS CoV‑2 aus zwei Hauptbestandteilen: genetisches Material (RNA) und Proteine. Die auf der Oberfläche des Virus befindlichen Proteine, die so genannten Antigene, werden vom Immunsystem erkannt, so dass es auf das Virus reagiert und eine Erkrankung verhindert. Es gibt mehrere Teile des Immunsystems, die den Schutz vor Viren gewährleisten. Wenn unser Immunsystem ein virales Antigen erkennt, das vielleicht von einer früheren Infektion stammt, produzieren Immunzellen, die so genannten B‑Zellen, Antikörper, die an das Virus binden und anderen Zellen des Immunsystems signalisieren, das Virus zu zerstören.
Diese Erkennung erfolgt durch einen Teil des Immunsystems, der sich an frühere Infektionen erinnert, das so genannte "adaptive Immunsystem", das aus B‑Zellen und T‑Zellen besteht. Die T‑Zellen helfen den B‑Zellen bei der Produktion von Antikörpern, aktivieren andere Abwehrkräfte und weisen andere Zellen an, das Virus zu vernichten. Es wird als adaptiv bezeichnet, weil jede Infektion zu T- und B‑Zellen führt, die speziell auf diese Infektion abgestimmt sind. Wenn jemand erneut mit demselben Virus in Kontakt kommt, erinnern sich diese T- und B‑Zellen (die so genannten "Gedächtniszellen") an die alte Infektion und vermehren sich rasch, um sie zu bekämpfen, ohne dass die Person krank wird.
Wie Impfstoffe das Immunsystem "austricksen":
Anstatt diese "Gedächtniszellen" durch eine natürliche Infektion zu erhalten, gaukelt eine Impfung dem Körper vor, er sei infiziert worden, obwohl dies nicht der Fall ist, so dass das Immunsystem diese "Gedächtnis"-T-Zellen und ‑B-Zellen entwickelt. Wenn eine Person dann zum Beispiel SARS-CoV‑2 ausgesetzt wird, verfügt ihr Körper über Gedächtnis-B-Zellen und T‑Zellen, die die Antigene auf der Oberfläche des Virus erkennen und die Produktion von Antikörpern zur Bekämpfung des Virus auslösen.
Antikörpertests per Fingerstichprobe helfen dabei, sich ein Bild zu machen, aber sie erzählen nicht die ganze Geschichte:
Unsere Tests zum Nachweis von Antikörpern sind zwar ein hilfreiches Maß für frühere Infektionen und die Wirkung des Impfprogramms, aber diese Ergebnisse sagen nichts über die Zahl der Menschen aus, die einen Schutz gegen COVID-19 haben. Das liegt daran, dass sie nur einen Teil des adaptiven Immunsystems messen. Während Antikörper leicht aus einer relativ kleinen Blutmenge, z. B. aus einem Fingerstich, nachgewiesen werden können, sind für andere Teile des Immunsystems, wie z. B. T‑Zellen, größere Blutproben und eine speziellere Laborausrüstung zur Verarbeitung und Bewertung erforderlich. Dies wäre in einer so großen Studie wie unserer Erhebung nicht möglich.
Wenn wir eine Blutprobe auf das Vorhandensein von Antikörpern testen, können wir ein negatives Ergebnis erhalten, weil die Person keine Antikörper hat oder die Antikörper zu gering sind, um den Wert zu erreichen, den der Test als positiv bezeichnet. Wenn eine Blutprobe zur Untersuchung ins Labor geschickt wird, wird sie Proteinen ausgesetzt, die denen des SARS-CoV-2-Virus sehr ähnlich sind, und ein positives Ergebnis liegt vor, wenn sich genügend Antikörper an das Virusprotein anlagern, um nachweisbar zu sein.
Der Wert, den der Test als positiv bezeichnet, ergibt sich aus dem Vergleich von Gruppen, die die Infektion definitiv nicht durchgemacht haben (Blutproben von Blutspendern, die Anfang 2019 entnommen wurden, bevor SARS-CoV‑2 die Menschen infizierte), und von Menschen, die die Infektion definitiv durchgemacht haben (Blutproben von Menschen, denen es so schlecht ging, dass sie im Krankenhaus landeten). Ein "positives" Testergebnis bedeutet also, dass die Antikörper ein hohes Niveau erreicht haben, ähnlich wie bei Menschen, die ins Krankenhaus eingeliefert wurden.
Ein negativer Antikörpertest bedeutet nicht, dass eine Person nicht geschützt ist:
Es kann sein, dass der Antikörpertest negativ ausfällt, aber die Antikörperspiegel im Vergleich zum Ausgangswert stark angestiegen sind – sie haben nur nicht den Wert erreicht, den der Test als "positiv" bezeichnet. Manche Menschen brauchen länger als andere, um ihre Antikörper zu erhöhen, so dass sie ihre Werte weiter erhöhen und den "positiven" Wert erreichen können, oder eben nicht.
Es kann sein, dass eine Person einmal positiv auf Antikörper getestet wurde, später aber ein negatives Testergebnis erhält, da die Antikörperspiegel im Laufe der Zeit auf natürliche Weise sinken können.
Derzeit wissen wir nicht, was dies für den Schutz vor einer Ansteckung mit COVID-19 bedeutet – dies ist einer der vielen Punkte, die die Studie herauszufinden versucht. Erste Studien an Beschäftigten im Gesundheitswesen deuten darauf hin, dass Menschen einen gewissen Schutz vor einer COVID-19-Infektion erhalten, wenn sie ihre Antikörper erhöht haben, aber immer noch unter dem "positiven" Wert liegen, aber wir wissen noch nicht genau, um wie viel. Wir wissen auch nicht, ob sinkende Antikörperspiegel das Risiko erhöhen, erneut an COVID-19 zu erkranken – die T‑Zellen, die bei Antikörpertests nicht gemessen werden, sind ein Grund, warum Menschen möglicherweise noch geschützt sind…«
blog.ons.gov.uk (29.4.21)
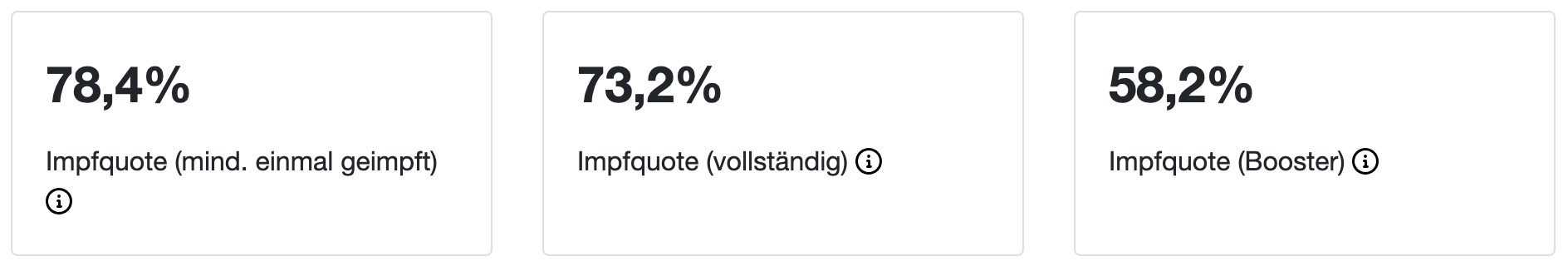
"Impfquote" in GB
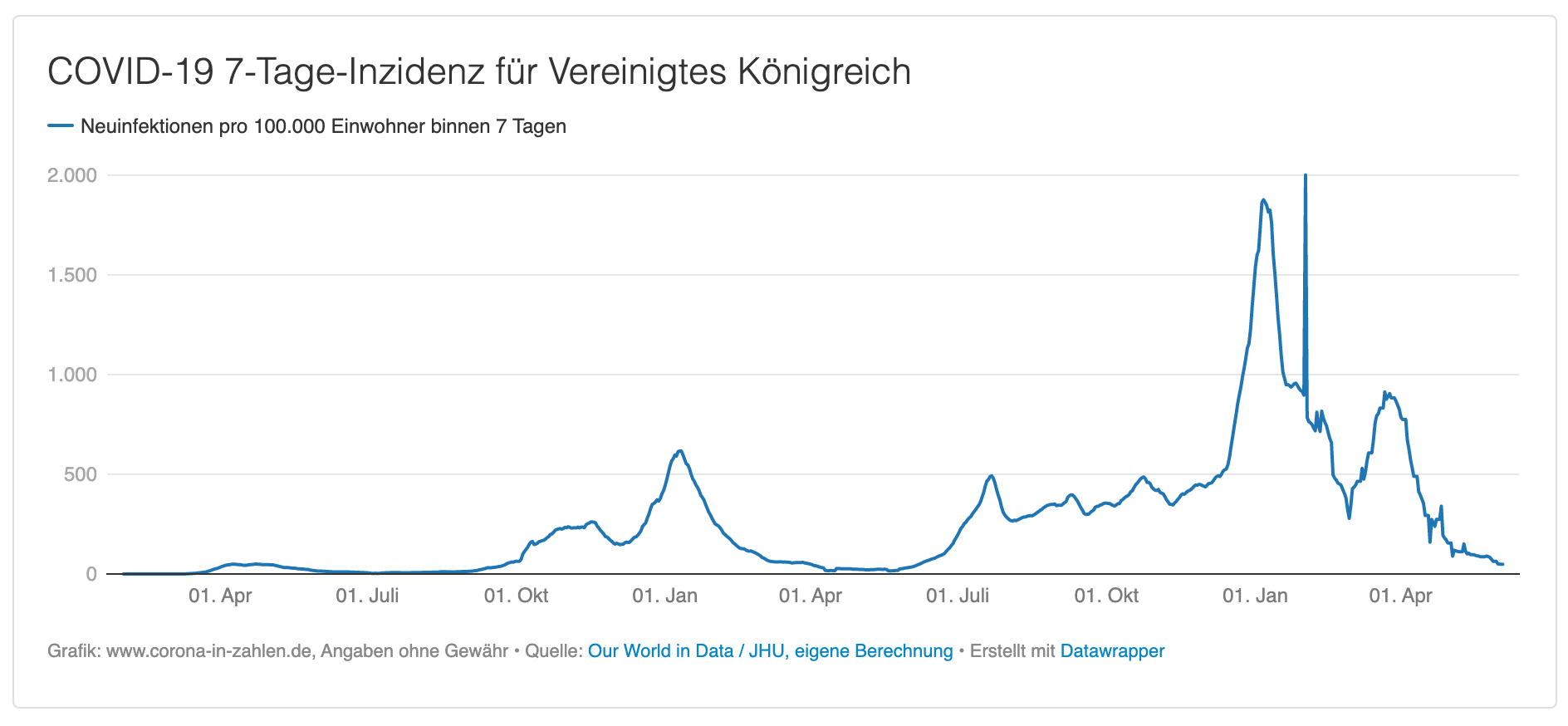
Und so grassieren die neuen Mutanten:
Angeregt durch
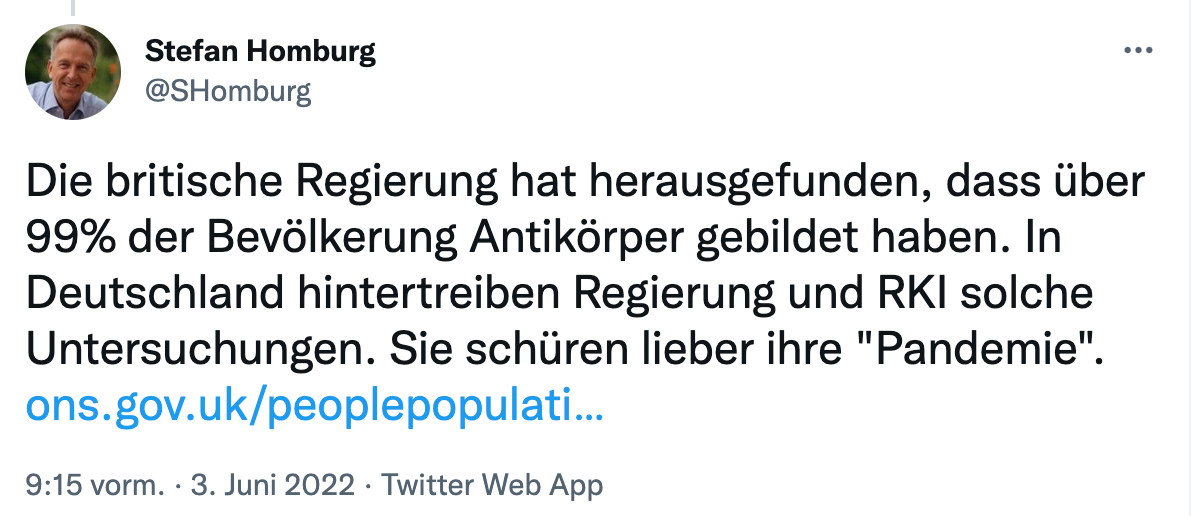

Nach mehr als 2 Jahren sollte jeder gelernt haben:
Fakten sind irrelevant – was zählt ist ALLEIN der Glaube !
Stefan Homburg
@SHomburg
·
11 Std.
Das geltende IfSG erlaubt durchaus Maßnahmen, aber nur bei konkreter Gefahr (Hotspots). Der Ruf nach "Möglichkeit von Maßnahmen" im Herbst ist deshalb Rosstäuscherei. In Wahrheit will man sie ohne konkrete Gefahr verhängen, wie gehabt.
@MarcoBuschmann
wdr.de:
„Impfquote bei Kindern und Jugendlichen hochfahren
Gebauers Parteikollegin, Bundesbildungsministerin Bettina Stark-Watzinger (FDP), plädiert zur Vorbereitung auf den Herbst und Winter dafür, die Corona-Impfquote bei jungen Menschen zu erhöhen. "Schon jetzt ist absehbar, dass wir die Impfangebote rechtzeitig hochfahren müssen, möglichst niedrigschwellig und nach der Empfehlung der Stiko gerade auch für Kinder und Jugendliche an den Schulen", sagte sie den Zeitungen der Funke Mediengruppe.“
https://www1.wdr.de/nachrichten/themen/coronavirus/corona-nrw-schule-kita-schliessung-100.html
https://twitter.com/shomburg
« Deutsches Primatenzentrum · Leibniz-Institut für Primatenforschung · Göttingen
Coronavirus-Erkältung
Derzeit sind vier Arten von Coronaviren bekannt, NL63, OC43, 229E und HKU1, die weltweit verbreitet sind und ganzjährig den Menschen infizieren. Eine Infektion mit diesen Viren verursacht in der Regel milde Atemwegserkrankungen. Man schätzt, dass etwa 30 Prozent aller Patienten mit Erkältungen, die beim Arzt vorstellig werden, eine Coronavirus-Infektion durchlaufen. Schwere Krankheitsverläufe sind selten (…) Analog zu den Coronaviren des Menschen wurden Coronaviren auch in verschiedenen Tieren nachgewiesen (unter anderem in Igeln, Fledermäusen, Schweinen, Kamelen, Rindern und Vögeln), in denen sie teilweise schwere Erkrankungen des Verdauungstrakts und des Nervensystems hervorrufen. (…) »
https://www.dpz.eu/de/infothek/wissen/coronaviren.html
Da ist er wieder Jeremy Farrar, der Direktor vom Welcome Trust. Einer der Architekten und tragenden Figuren schon bei der Schweinegrippe 2009!
Ich kann auch das Gerede bezüglich der Wirkung bzw. Bedeutung von Antikörpern nicht mehr hören, denn es ist schon seit circa 30 Jahren bekannt, dass diese besonders bei der Abwehr von respiratorischen Erregern nur eine sehr untergeordnete Rolle einnehmen. (1,2,3,4,5 …) Das natürliche Immunsystem (T‑Zellen) wird übrigens auch durch Varianten nicht ausgehebelt bzw. überlistet, aber der durch die "Impfungen" vermittele Schutz nur durch zirkulierende spezifische Antikörper schon.
Eine sehr gute Zusammenfassung diesbezüglich bietet auch der Vortrag von Frau Prof. Brigitte König.
Zur Person:
Prof. Dr. med. rer. nat. habil. Brigitte König hat Biologie, Chemie und Medizin studiert, sich im Fach „Medizinische Mikrobiologie und Infektionsimmunologie“ habilitiert und ist stellvertretende Direktorin des Instituts für Medizinische Mikrobiologie und Infektionsepidemiologie am Universitätsklinikum Leipzig und gehört als externe Professorin dem Lehrstuhl der Medizinischen Fakultät an der Otto-von-Guericke-Universität in Magdeburg an.
Vortrag von Frau Prof. König – Ärztefortbildungsveranstaltung im Dr.- Bruker-Haus zur Schutzimfpung und den Grundlagen der Immunologie >>> https://www.youtube.com/watch?v=yIpXt76ikNM
(1) T cell-mediated immune response to respiratory coronaviruses >>> https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4125530/
(2) The CD8 T Cell Response to Respiratory Virus Infections >>> https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5900024/
(3) Comprehensive analysis of T cell immunodominance and immunoprevalence of SARS-CoV‑2 epitopes in COVID-19 cases >>> https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(21)00015‑X?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS266637912100015X%3Fshowall%3Dtrue#relatedArticles
(4) SARS-CoV-2-specific T cells without antibodies >>> https://www.nature.com/articles/s41577-020‑0393‑3
(5) T cells recognize recent SARS-CoV‑2 variants >>> https://www.nih.gov/news-events/news-releases/t‑cells-recognize-recent-sars-cov-2-variants
zählt nicht – wird ignoriert – immunität ist doch quatsch und falls es das geben sollte, nur 6 wochen gültig – haben sie uns doch eingetrichtert – hochfahren, klar, vorbereiten, durchimpfen – ich schlage vor, wir fangen jetzt mal mit den "antreibern" an und zwar im wöchtenlichen spritzrhythmus mit allen substanzen, die sich dr. fauci vorstellen kann, benzin, schweröl, chilli, aecton, ist doch vollkommen egal, hauptsache es fließt geld … ja und testen, testen, testen. ich hab da eine neue idee noch ein bischen heroin mit an die teststäbchen, dann hat man wenigsten noch was davon … – langsam kann ich den schmarrn nicht mehr lesen !!!!!!! geschweigedenn ertragen !!!!!!!!!!
[ 23.04.2014 ] Received: 23 April 2014 / Revised: 4 June 2014 / Accepted: 5 June 2014 / Published: 10 June 2014
Vet. Sci. 2014, 1(1), 40–62; doi.org/10.3390/vetsci1010040
Non-Human Primate Models of Orthopoxvirus Infections
Anne Schmitt , Kerstin Mätz-Rensing and Franz-Josef Kaup
Pathology Unit, German Primate Center, Leibniz Institute for Primate Research, Göttingen, Germany
Abstract
Smallpox, one of the most destructive diseases, has been successfully eradicated through a worldwide vaccination campaign. Since immunization programs have been stopped, the number of people with vaccinia virus induced immunity is declining. This leads to an increase in orthopoxvirus (OPXV) infections in humans, as well as in animals. Additionally, potential abuse of Variola virus (VARV), the causative agent of smallpox, or monkeypox virus, as agents of bioterrorism, has renewed interest in development of antiviral therapeutics and of safer vaccines. Due to its high risk potential, research with VARV is restricted to two laboratories worldwide. Therefore, numerous animal models of other OPXV infections have been developed in the last decades. Non-human primates are especially suitable due to their close relationship to humans. This article provides a review about on non-human primate models of orthopoxvirus infections.
https://www.mdpi.com/2306–7381/1/1/40
·
Anne Schmitt , Kerstin Mätz-Rensing and Franz-Josef Kaup
Non-Human Primate Models of Orthopoxvirus Infections
1. Introduction
The genus Orthopoxvirus (OPXV), as part of the Poxviridae, includes, among others, the species variola virus (VARV), monkeypox virus (MPXV), cowpox virus (CPXV), vaccinia virus (VACV), and mousepox virus. The causative agent of smallpox, VARV, was one of the most dangerous viruses known to mankind, being responsible for the death of 300 to 500 million people. Fortunately, smallpox has been successfully eradicated by a worldwide vaccination campaign under the leadership of the World Health Organization (WHO) [1]. (…)
2. Monkeypox
MPXV is an Orthopoxvirus which causes a zoonotic disease characterized by symptoms similar to smallpox but with a lethality rate of 1%–8% [2,22]. In all probability, some monkeypox infections were misinterpreted as smallpox because of the lack of laboratory testing [23]. One clinical symptom, which allows a differentiation from smallpox, is lymphadenopathy, which could lead to the conclusion that there is a more effective immune response [24,25]. MPXV was first detected in 1957 in captive primates in Denmark [26]. (…)
Summary Monkeypox
Although MPXV has only been detected in African non-human primates, Asian macaques like rhesus and cynomolgus macques, which are not natural hosts, are the most often used species for MPXV models. This may be due to the fact that these species are widely spread in animal experiments, easy available and have been well investigated [15]. Both species are susceptible to MPXV, but rhesus macaques seem to be less susceptible than cynomolgus macaques, as observed in an US outbreak in 1960 [15,60]. Concerning the appropriate inoculation route, none mimics sufficiently natural infection with VARV or MPXV. The exact transmission route for MPXV is still not clear, which makes it more difficult to evaluate transmission routes. Additionally, the inoculum dose in natural infections may be lower than those inoculated experimentally. Intravenous models of MPXV infection skip infection of respiratory tissue and incubation phase and, therefore, do not mimic the natural route of transmission. Nevertheless, they cause systemic disease with mortality rates up to 100%. This makes the intravenous model interesting for vaccine and therapeutical studies concerning smallpox [15]. (…)
(…)
5. Conclusions
The main cause of NHP studies is to develop models to test new antiviral therapeutics and vaccines and to get a deeper insight into pathogenesis of OPXV infections. (…) Concerning smallpox research, cynomolgus macaques infected with MPXV are, thus far, the best model for human smallpox [70]. Models, which use VARV, have the advantage that the original causative agent for human smallpox is used—but handling VARV is dangerous and can only be done in two laboratories worldwide.
In the last decades, promising new animal models have been developed, but none of them is good enough to safely predict a response to new therapeutics or vaccines in humans. Thus, there is a need for more research in this area. The next years will lead to interesting new findings concerning OPXV pathogenesis and development of new compounds driven by concerns of bioterrorism and increasing zoonotic potential of OPXV. »
https://www.mdpi.com/2306–7381/1/1/40/htm
Vet. Sci. 2014, 1, 40–62; doi:10.3390/vetsci1010040
https://mdpi-res.com/d_attachment/vetsci/vetsci-01–00040/article_deploy/vetsci-01–00040.pdf
https://mdpi-res.com/d_attachment/vetsci/vetsci-01–00040/article_deploy/vetsci-01–00040.pdf?version=1402389040
·
Viruses. 2017 Dec; 9(12): 363.
Published online 2017 Nov 28. doi: 10.3390/v9120363
Dynamics of Pathological and Virological Findings During Experimental Calpox Virus Infection of Common Marmosets (Callithrix jacchus)
Anne Schmitt , Li Lin Gan , Ahmed Abd El Wahed , Tingchuan Shi , Heinz Ellerbrok , Franz-Josef Kaup , Christiane Stahl-Hennig , and Kerstin Mätz-Rensing
1. Introduction
Although smallpox was successfully eradicated in 1980 [1], its causative agent, variola virus (VARV) still remains of concern because of the possible intentional release by bioterrorism [2,3]. Moreover, cessation of cross-protective smallpox vaccination has led to waning herd immunity, not only against VARV, but also against other orthopoxviruses (OPXV) [4]. As a consequence, human OPXV infections with monkeypox (MPXV) and cowpox (CPXV) are increasing [5,6,7].
MPXV is endemic in Central and Western Africa, with a 20-fold increase in human monkeypox incidence in the Democratic Republic of Congo over a 20-year period (between the 1980s and 2000s) [8,9]. In 2003, MPXV was accidentally imported into the US by MPXV-infected rodents from West Africa. The virus was transmitted via prairie dogs to some 40 humans [10]. In Europe CPXV infections in humans as well as in animals are also increasing [11,12,13,14]. (…)
Therefore, development of medical interventions and new vaccine strategies and studies on pathogenesis are essential and require animal models, on which the efficacy of new vaccines and therapeutics can be tested. (…)
Calpox virus is grouped together with CPXV, which was isolated in 1980 from a local skin lesion of an elephant in Germany [47]. (…)
4. Discussion
OPXV models are urgently needed to test new therapeutics and vaccines against emerging OPXV infections and to develop countermeasures against a potential bioterrorist smallpox attack. (…)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5744138/
·
Ellerbrok
https://www.corodok.de/?s=ellerbrok
·
“Stop mass hysteria monkeypox virus outbreak propaganda”
@एडवर्ड फॉन रॉय: Danke, habe das aufgegriffen für Wie Herr Ellerbrok vom RKI zu Affen und Pocken forschte.
@aa Ein herzliches Danke zurück.
Liebe Briten, herzlichen Glückwunsch zur erfolgreichen Durchseuchung!
Mehr als 99 % der Menschen haben offiziell Antikörper gegen SARS-CoV‑2
Ach wirklich? So ein Käse! Jeder Organismus bildet Antikörper, wenn das nicht so wäre gäbe es noch nicht einmal Mäuse.