»Bis zum 03.03.2022 sind dem Paul-Ehrlich-Institut 859 Verdachtsfälle einer Nebenwirkung nach Comirnaty® bei Kindern im Alter von 5–11 Jahren berichtet worden. Die Melderate beträgt vier Fälle auf 10.000 Impfungen, Mädchen und Jungen waren etwa gleich häufig betroffen. Die überwiegende Mehrzahl der unerwünschten Reaktionen war nicht schwerwiegend. Die gemeldeten Reaktionen ähneln denen in klinischen Prüfungen vor Zulassung. Ein neues Risikosignal wurde nicht identifiziert. Bis zum Stichtag der Auswertung wurde kein Fall einer bestätigen Myokarditis und/oder Perikarditis berichtet.«
pei.de (31.3.)
Dann ist offenbar alles in Ordnung. Die Nebenwirkungen waren erwartet.
Schließlich hatte man Studien mit ganzen 3.000 Kindern vorgenommen:
»Zum Zeitpunkt der Zulassung waren Sicherheitsdaten aus klinischen Prüfungen bei mehr als 3.000 Kindern im Alter von 5–11 Jahren verfügbar…
Im nachfolgenden Text umfasst der Begriff der Nebenwirkung (Definition im Arzneimittelgesetz) auch die als über das übliche Ausmaß einer Impfreaktion hinausgehende gesundheitliche Schädigung (Definition des Infektionsschutzgesetzes). Schwerwiegende Nebenwirkungen sind nach § 4 des Arzneimittelgesetzes Nebenwirkungen, die tödlich oder lebensbedrohend sind, eine stationäre Behandlung oder Verlängerung einer stationären Behandlung erforderlich machen, zu bleibender oder schwerwiegender Behinderung, Invalidität, kongenitalen Anomalien oder Geburtsfehlern führen…
Insgesamt 859 Meldungen bezogen sich auf den Impfstoff Comirnaty®, wobei ca. zwei Millionen Comirnaty®-Impfdosen in der Altersgruppe verimpft wurden: 55,36 Prozent der Impfungen traten nach Erstimpfung auf, 44,52 Prozent nach Zweitimpfung und 0,12 Prozent bezogen sich auf eine Auffrischimpfung. Mädchen und Jungen waren etwa gleich häufig betroffen. Die Charakteristika der Verdachtsfallmeldungen zeigt Tabelle 1. «
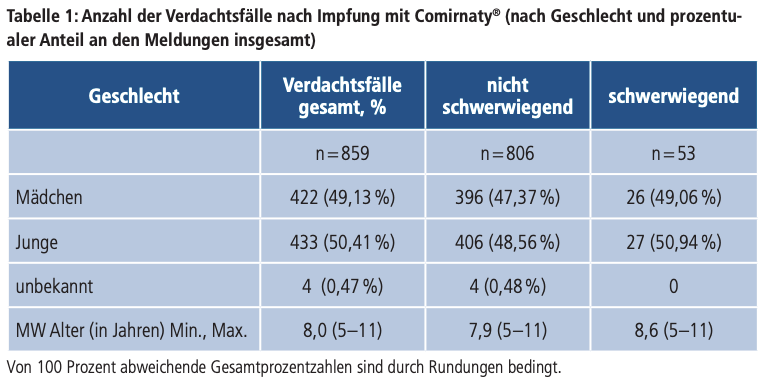
»Die Melderate von Verdachtsfällen einer Nebenwirkung betrug 43 Verdachtsfallmeldungen auf 100.000 Impfungen und für schwerwiegende Reaktionen 2,65 Verdachtsfallmeldungen auf 100.000 Impfdosen.… «
»Die Mehrzahl der gemeldeten schwerwiegenden unerwünschten Reaktionen bezog sich auf bekannte Lokal- und Allgemeinreaktionen oder eine Synkope. Drei Meldungen beschreiben eine Fazialisparese (Gesichtsparese) im Abstand von 1–13 Tagen nach der Impfung. Bei Kindern im Alter von 1–15 Jahren wird die Inzidenz einer idiopathischen Fazialisparese mit 6,1 Fällen pro 100.000 Personenjahre angegeben. Unter Berücksichtigung dieser Hintergrundrate ist die Zahl der Meldungen nicht höher als der zufällige Erwartungswert innerhalb eines Zeitabschnitts von 13 Tagen (Erwartungswert 4,34 Fälle innerhalb von 13 Tagen). Ein Risikosignal ergibt sich aus der Zahl der Meldungen einer Fazialisparese derzeit nicht. In klinischen Prüfungen vor der Zulassung wurde bei geimpften Erwachsenen eine höhere Zahl von idiopathischen Fazialisparesen im Vergleich zur Placebogruppe festgestellt, weshalb Fazialisparese als Nebenwirkung in die Fachinformation aufgenommen wurde.
In vier Fällen wurde eine Vaskulitis nach Impfung berichtet, davon drei Fälle einer Purpura Schönlein-Henoch (PSH; IGA-Vaskulitis, auch als Henoch-Schoenlein-Purpura bezeichnet),..In den drei dem Paul-EhrlichInstitut gemeldeten Fällen einer PSH fehlen wichtige klinische Informationen zu Risikofaktoren. Auch ist die Zahl der gemeldeten Fälle nicht höher als die zufällig zu erwartende Anzahl in der Population. Die Parästhesie ist eine nach der Zulassung beobachtete Nebenwirkung von Comirnaty®.
Zwei Verdachtsmeldungen beziehen sich auf Kinder, bei denen ein pädiatrisches inflammatorisches Multiorgansyndrom (pediatric inflammatory multisystem syndrome, PIMS, auch als multisystemisches Entzündungssyndrom bei Kindern, multisystem inflammatory syndrome in children, MIS‑C, bezeichnet) diagnostiziert wurde. Im Fall eines zehnjährigen Kindes war der Symptombeginn fünf Tage nach der ersten Comirnaty®-Impfung. Im zweiten Fall begann die Symptomatik bei einem siebenjährigen Kind 24 Tage nach der dritten Impfung mit Comirnaty®. Beide Kinder konnten nach Behandlung auf der Intensivstation im Krankenhaus nach kurzer Zeit im gebesserten Allgemeinzustand nach Hause entlassen werden. Im Fall des siebenjährigen Jungen, welcher der Falldefinition des PIMS gemäß Brighton Collaboration entspricht,7 deuten die serologischen Untersuchungen darauf hin, dass der Junge keine Infektion mit SARS-CoV‑2 durchgemacht hatte. Im anderen Fall liegen bisher keine serologischen Untersuchungen vor, die eine vorhergehende asymptomatische SARS-CoV2-Infektion ausschließen könnten. Auch fehlen derzeit noch weitere wichtige klinische Befunde…
Die Ergebnisse in diesem Bericht unterliegen Einschränkungen. Die Daten wurden im Rahmen eines passiven Überwachungsmeldesystems gesammelt und analysiert und unterliegen insofern einer Verzerrung durch Untererfassung der Meldungen – insbesondere nicht schwerwiegender Nebenwirkungen – und einer Übererfassung von zeitlich koinzidenten Ereignissen, die nicht kausal auf die Impfung zurückzuführen sind. Auch fehlen in einigen Berichten wichtige Angaben zur Anamnese und zu differenzialdiagnostischen Untersuchungen, sodass der Zusammenhang mit der Impfung nicht beurteilt werden kann. Schließlich sind diese Daten durch den kurzen Überwachungszeitraum begrenzt und könnten sich ändern, da im Rahmen der Spontanerfassung weitere Daten erfasst und analysiert sowie weitere Kinderimpfungen durchgeführt werden.«
Im Zusammenhang mit den letzten Ausführungen ist ein weiterer Beitrag in diesem Bulletin interessant:
»Nebenwirkungsmeldungen in Deutschland: Aktuelles und Hintergründe
Das Wissen um die Sicherheit von Arzneimitteln zum Zeitpunkt ihrer Markteinführung ist begrenzt. Spezifische Risiken eines neuen Wirkstoffes oder einer neuen Kombination etablierter Wirkstoffe oder auch nur einer neuen Darreichungsform in der breiten ärztlichen Anwendung, beispielsweise für bestimmte Patientengruppen, zeigen sich manchmal erst Jahre nach der Zulassung des Arzneimittels…
Obwohl seit vielen Jahren, insbesondere bei Patientenmeldungen, ein deutlicher Anstieg der Meldezahlen festzustellen ist, legt die Entwicklung der aktuellen Meldezahlen an das BfArM die Vermutung nahe, dass das aktuelle Pandemiegeschehen dazu führt, dass ein signifikanter Anteil von Nebenwirkungen ohne Vakzinbezug nicht gemeldet wird, also ein Underreporting von Nebenwirkungsfällen, die nicht mit Covid-19-Impfungen assoziiert sind, vorliegt…«
Warum sich das nicht auf die Meldungen "mit Vakzinbezug" auswirken sollte, bleibt unklar.
»Zwar erhalten nur die Wirkstoffe eine Zulassung, die in diesen Studien ein positives Nutzen-Risiko-Verhältnis aufweisen, deren Einsatz für Patienten also mehr Nutzen als Risiken zu bringen verspricht und damit eine Therapie rechtfertigen. Dennoch ist die Datenlage bei Erteilung der Zulassung hinsichtlich sehr seltener Nebenwirkungen, Risiken in der Langzeitanwendung, Arzneimitteltherapiesicherheit, Wechselwirkungen oder speziellen Risiken für bestimmte Patientengruppen (z.B. Schwangere, Kinder oder ältere Patienten)… noch begrenzt, und Anwendungsrisiken werden teilweise erst Jahre nach der Zulassung aus der Erfahrung in der breiten Bevölkerung evident…«
Predigen uns die "ExpertInnen" nicht seit Monaten, daß Langzeitwirkungen bei den "Impfstoffen" per definitionem ausgeschlossen sind?
»DEFINITION EINER NEBENWIRKUNG
Unter einer Nebenwirkung versteht man laut Arzneimittelgesetz (§ 4 Abs. 13 AMG) jede schädliche und unbeabsichtigte Reaktion auf ein Arzneimittel; in der Humanmedizin ist dies losgelöst von den Vorgaben der Produktinformationen. Somit gelten auch schädliche Reaktionen am Patienten als Nebenwirkung, die im Zusammenhang mit Medikationsfehlern, Missbrauch oder Off-Label-Use (Anwendung außerhalb der Zulassungsbedingungen im Sinne der ärztlichen Therapiefreiheit) auftreten bzw. auf den nicht bestimmungsgemäßen Gebrauch zurückzuführen sind…
Spontan berichtete Nebenwirkungsverdachtsfälle (d.h., die Meldung stammt nicht aus systematisierten Untersuchungen, in denen u.a. Nebenwirkungen erfasst werden) müssen keine explizite Kausalitätsbeurteilung durch die meldende Person enthalten. Hier ist der Verdacht auf einen kausalen Zusammenhang zwischen dem Arzneimittel und der aufgetretenen Nebenwirkung bereits durch die Meldung selbst impliziert, da sie andernfalls wohl nicht erfolgt wäre. Dennoch ist die medizinische Beurteilung eines Falles durch den behandelnden Arzt, der den betroffenen Patienten und seine Krankengeschichte kennt, eine für die Behörden wertvolle und im Einzelfall nicht ersetzbare Information. Von dieser generellen Betrachtungsweise der Kausalität bei Spontanberichten wird nur dann abgewichen, wenn die meldende Person einen solchen Zusammenhang ausdrücklich verneint. Der Begriff des „Verdachts“ bedeutet gleichzeitig, dass ein kausaler Zusammenhang nicht bewiesen sein muss, bevor eine Meldung erfolgt. Ein lückenloser Beweis wird nur in den seltensten Fällen geführt werden können, wenn überhaupt.«
Als Kurzmeldung werden in dem Bulletin diese Informationen abgefaßt:
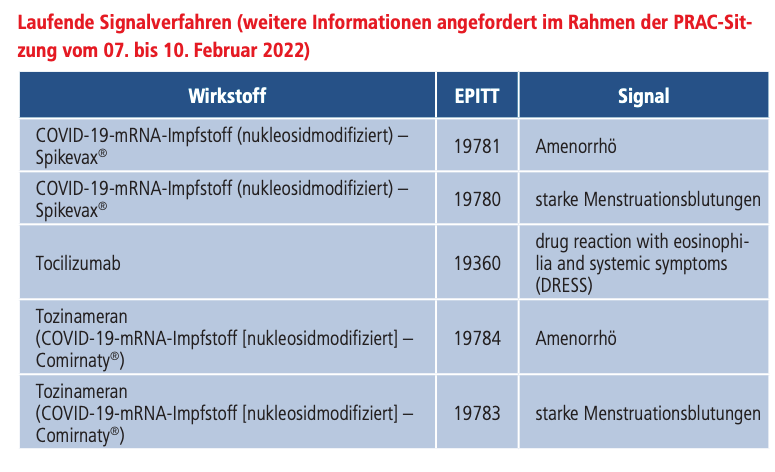
Eine Amenorrhoe ist das Ausbleiben der Menstruation. PRAC ist der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz der EMA (Pharmacovigilance Risk Assessment Committee). Preisfrage: In welchem Qualitätsmedium war von diesen Signalverfahren zu lesen oder zu hören? Oder davon:

„Im zweiten Fall begann die Symptomatik bei einem siebenjährigen Kind 24 Tage nach der dritten Impfung mit Comirnaty®.“
Siebenjähriges Kind … dritte Impfung.
Finde den Fehler!
@King Nothing
Fehler Nummer eins: Comirnaty® ist eine experimentelle Gen-Therapie
mit einem vom Hersteller nachgewiesenen positiven Einfluss im Zeitraum
von einigen Wochen betrachtet ab 14 Tagen nach der Injektion.…
Aber Du meinst Fehler Nummer zwei:
.
Ein Vater aus der Pharmabranche erklärte mir, er wäre für sich bewußt
das Risiko des mRNA "Impfstoffs" eingegangen – ich glaube er hätte
beruflich auch keine Alternative. Seisdrum, er hätte alle Impfungen
die man bekommen könne, weil das würde seinen Immunschutz stärken.
Daher hätte er auch sein Kind (sechs Jahre) impfen lassen.
Vor der Schule warb er unter Eltern "dann kommt der Impfbus zu Schule"
Wovon er nicht sprach individuelle Nutzen/Risko Abwägung.
.
Wo das Risiko für Kinder durch Erkrankung bekannterweise klein ist,
erübrigt sich die Überlegung Prophylaktisch Pharmaprodukte zu konsumieren.
.
Also, was ist die Motivation? Wahn?
@Schneemann: Die Angst um das Wohlergehen des eigenen Kindes. Das will ich den Eltern nicht mal absprechen. Aber diese Angst wurde eben erzeugt und ist gerade in diesem jungen Alter völlig unverhältnismäßig.
Blöd, wenn es bei
4.077.958 Infektionen bei 0–14 Jährigen
52 Todesfälle in ca. 27 Monaten gab. Das sind immerhin
0,0000128% zuviel, die durch eine Impfung hätten gerettet werden können.
https://www.corona-in-zahlen.de/weltweit/deutschland/#weitereKennzahlen
Uups, ich hab mich bei der Prozentangabe verrechnet…
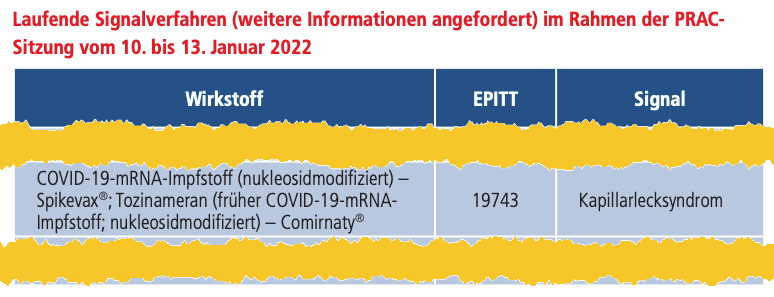
Apropos PRAC:
„Latest safety assessments
Comirnaty (BioNTech Manufacturing GmbH)
Capillary leak syndrome (CLS)
No update to the product information required
An assessment of whether vaccination with Comirnaty can cause capillary leak syndrome (CLS) has been completed. PRAC has concluded that there are currently insufficient data to support an update of the product information.“
Quelle:
https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccines-safety-update-17-march-2022_en.pdf
Kurz den Taschenrechner gezückt… (mal wieder) . 4 Fälle pro 10000 macht bei 859 Fällen 2,15 Mio ge"impfte" zwischen 5 und 11 Jahren – bei 5,3 Mio Kids in diesem Alter wäre das eine Quote von etwa 41 % – bei statista.blabla und Konsorten kommen sie grad mal auf 21 % – wie kann man eigentlich nur so Scheiße lügen? Und das sind ja nur die "Zahlen" für "Comirnaty"
21 Prozent geimpfte Kinder bei Null eigenem Risiko und ungewissen Konsequenzen in dem Alter ist heftig genug. Da haben die Eltern gedacht, dass sie sich mit der Impfung der Kinder selbst schützen, und das war eine Lüge.
@herr brehm: Da 10000 Impfungen auf nur 5000 Impflinge fallen( – mindestens Doppelimpfung!), ist diese Berechnung sowieso ein Taschenspielertrick, um das Risiko von Impfnebenwirkungen nur halb so hoch erscheinen zu lassen!
@Herr Brehm: Die Rechnung ist schon richtig – es geht um 4 Fälle pro 10.000 Injektionen, nicht pro Impflinge. Das Risiko ist dann pro Impfling je nach geforderter Anzahl Impfungen – KL fordert ja schon die vierte – entsprechend höher.
Nimmt man zwei Injektionen an, passt die Quote auch wieder
Wie hoch die Untererfassung bei Kindern wohl ist? Ich vermute, wer seine Kleinen bis zum Booster schleppt, wird sich mit aller Macht gegen das Eingeständnis von Nebenwirkungen sperren. Ist aber nur Spekulation. Wäre mal interessant zu untersuchen.
Verehrtes PEI!
da Sie die Corona-Impfstoff-Nebenwirkungsdatenbanken nun an die EU ausgelagert haben, haben sie nun bestimmt Langeweile:
"The next batch of Pfizer vaccine documents from the FDA has been produced (11,043 pages), as well as an unredacted version of the post-marketing experience report, available at http://phmpt.org/pfizers-documents/"
https://twitter.com/AaronSiriSG/status/1510007408344461313